Топічний метронідазол у лікуванні розацеа
Л.А. Болотна Харківська медична академія післядипломної освіти
Мета роботи — вивчити ефективність різних варіантів застосування крему метронідазолу 1 % («Розамет®») у складі комплексної терапії хворих на розацеа.
Матеріали та методи. Під наглядом перебувало 40 пацієнтів з розацеа папуло-пустульозного підтипу. «Розамет®» призначали у вигляді монотерапії у разі легкого ступеня тяжкості та в складі комбінованої терапії за середнього ступеня. Ефективність терапії вивчали на підставі динаміки шкали діагностичної оцінки розацеа і частоти рецидивів дерматозу.
Результати та обговорення. Засвідчено високу ефективність (22,5 % клінічне вилікування, 62,5 % значне поліпшення) крему «Розамет®», який призначали двічі на добу протягом 8 тиж. Продовження зовнішньої терапії кремом раз на добу протягом 8 тиж сприяло регресу клінічних виявів, зменшенню кількості рецидивів у 4 рази.
Висновки. Топічний метронідазол 1 % (крем «Розамет®») є препаратом вибору для зовнішної терапії розацеа папуло-пустульозного підтипу. Використання крему «Розамет®» можливо застосовувати в якості тривалої підтримувальної терапії у хворих на розацеа.
Ключові слова: розацеа, патогенез, лікування, метронідазол (1 % крем), «Розамет®», ефективність.
Розацеа — мультифакторное хроническое рецидивирующее заболевание кожи, поражающее преимущественно центральную часть лица, характеризуется стадийностью клинических про явлений, прогредиентным течением. Среди европейцев розацеа страдают от 1,5 до 10 % населения, в США — более 15 млн [4, 11, 20]. Следует учитывать, что распространенность заболевания имеет прямую корреляцию с его ранней диагностикой. В структуре дерматологической патологии розацеа составляет от 2 до 8 %, чаще всего пациенты обращаются при наличии персистирующей эритемы, телеангиэктазий, папул и пустул, а также более тяжелых вариантов болезни. В структуре акнеподобных дерматозов розацеа имеет наибольший удельный вес (36 %) [4]. У 6—50 % больных розацеа регистрируется поражение органа зрения (блефарит, конъюнктивит, халязион, ирит, иридоциклит, кератит). Розацеа оказывает значительное негативное влияние на качество жизни пациентов, сравниваемое с таким при тяжелых формах акне [1, 8, 12].
Розацеа относится к дерматозам среднего возраста, первые признаки заболевания могут отмечаться в 25—35 лет, достигая максимальной выраженности к 40—50 годам. Традиционно считается, что заболевание в 2—4 раза чаще и раньше возникает у женщин. Однако тяжелые стадии, такие как фимы, характерны в большей степени для мужчин в связи с более реактивным течением, запускающим пролиферативные процессы [5, 13].
Согласно современным представлениям, розацеа — это полиэтиологический дерматоз с участием в развитии универсальных патологических реакций и факторов: конституциональная ангиопатия, изменения в соединительной ткани дермы, микроорганизмы, дисфункция пищеварительного канала, оксидативный стресс и др. [7, 8, 23]. Установлено множество факторов, повышающих риск развития розацеа (возраст, фототип кожи, воздействие УФ-излучения, стрессы, длительное пребывание в условиях высоких и низких температур, острая и горячая пища, косметика, физические упражнения и др.) [12, 18]. Продолжаются дискуссии о том, чем являются варианты заболевания: различными фенотипами или же стадиями в рамках единого патологического прогрессирования?
В патогенезе розацеа сегодня выделяют следующие ключевые звенья: нарушения в функционировании врожденных иммунных реакций, опосредованных активацией TLR (Toll-like receptors), патология сосудов кожи лица и расстройства кожного барьера (увеличение трансэпидермальной потери влаги, низкий уровень влажности рогового слоя) [4, 7, 13, 16]. Результаты современных исследований предполагают участие кератиноцитов, гладкомышечных клеток, эндотелиальных клеток, макрофагов, мастоцитов, фибробластов, Th1/Th17-клеток, продуцирующих антитела В-клеток и нейронов в патобиологии розацеа [14].
Наиболее важными представителями семейства сигнальных паттерн-распознающих рецепторов, присутствующих на поверхности кератиноцитов, а также макрофагов дермы, являются TLR. Специфическое взаимодействие TLR с их лигандами активизирует сигнальные пути адапторных белков, протеинкиназ, транскрипционных факторов, воздействуя на экспрессию генов провоспалительных цитокинов — интерлейкинов (IL-1, IL-2, IL-4, IL- 6, IL-8, IL-10, IL-12), фактора некроза опухоли α, интерферона γ и ряда других, инициирующих развитие воспалительного процесса [3, 22].
Ключевую роль в кожном воспалительном процессе при розацеа играют TLR2, вызывают синтез молекул калликреина, матриксных металлопротеиназ, активных форм кислорода, азота окиси, цитокинов и хемокинов, изменяющих структуру сосудов, способствующих дегенерации коллагена, вызывающих клеточную ин фильтрацию и воспаление [14]. TLR2 могут активизироваться физическими факторами (УФ-из лучением, высокими и низкими температурами), нейропептидами при стрессе. Воздействие указанных факторов на TLR кожи здоровых людей приводит к контролируемому повышению уровня цитокинов и веществ с антимикробной активностью (кателицидинов, дефензинов). Установлено, что дисфункция кателицидинов может быть одним из центральных звеньев патогенеза дерматоза, некоторые типы кателицидина обладают вазоактивными и провоспалительными свойствами [23, 24]. Ряд исследователей указывают на значительную роль кателицидина LL-37 в развитии розацеа. Стимулирует продукцию этого пептида УФ-излучение, которое является одним из ведущих провоцирующих факторов.
Одним из триггеров активизации TLR2 является хитин клещей Demodex folliculorum, обнаружение которых прямо пропорционально коррелирует с воспалением на коже. Клещ-железница в процессе жизнедеятельности нарушает эпителиальный барьер, проникает в дерму и стимулирует TLR. Сальные железы больных папулопустулезной розацеа продуцируют кожное сало с измененным профилем жирных кислот, что в свою очередь способствует развитию клещей[16]. Кроме этого, антигенные белки, ассоциированные с Bacillusoleronius, находящейся в клеще D. folliculorum, рост бактерий Streptococcus и Staphylococcus могут стимулировать воспалительный ответ у пациентов с папуло-пустулезной розацеа. Таким образом, клещи Demodex могут быть причиной развития или обострения розацеа посредством различных механизмов: блокада волосяных фолликулов, секреция ферментов (протеазы), повреждение эпидермального барьера и запуск иммунных реакций [13]. Возможно, при розацеа существует параллель между пролиферацией клещей рода Demodex и сниженной цитотоксической активностью CD8+ Т-клеток, в то время как измененный Th1/Th17-ответ имеет важное значение в развитии воспаления [22].
Существенная роль в патогенезе розацеа отводится нарушению регуляции кровотока по лицевой вене, изменению тонуса поверхностных артериальных сосудов кожи в зоне иннервации тройничного нерва, что является следствием воздействия ряда экзогенных (инсоляция, воздействие высоких и низких температур) и эндогенных факторов (патология эндокринной системы, системы гемостаза, пищеварительного канала и др.) [7]. Широко обсуждается роль вазоактивных пептидов (сосудистый эндотелиальный фактор роста) и медиаторов (пентагастрин, вазоактивный кишечный пептид, эндорфины, брадикинин, серотонин, гистамин и субстанция Р) в механизме возникновения розацеа [4, 22].
Лечение больных розацеа представляет трудную задачу, так как многие аспекты этиологии и патогенеза заболевания остаются неясными, нет эффективных терапевтических методов, которые приводят к длительной ремиссии и клиническому выздоровлению [5, 8, 18]. Многочисленные способы лечения розацеа определяются разнообразием этиологических и патогенетических факторов, подтипом, вариантом дерматоза. Лечение предусматривает уменьшение воспалительных явлений, устранение предрасполагающих и провоцирующих факторов, коррекцию различных соматических нарушений, соблюдение диеты, фотопротекцию. Современные варианты лечения розацеа учитывают основные патогенетические мишени и предполагаемые молекулярные механизмы [12, 22]. Самым простым для лечения некоторые авторы считают папуло-пустулезный подтип в связи с хорошим ответом на системные и топические препараты (антибиотики, метронидазол), в то время как эритематозно-телеангиэктатический, наоборот, более резистентный к традиционной терапии [24]. Хорошие результаты получены при применении импульсных лазеров на красителях с длиной волны 585 и 595 нм, интенсивного импульсного света в лечении персистирующей эритемы и телеангиэктазий [15].
Несомненно, розацеа относится к заболеваниям, течение которых в большинстве случаев можно контролировать. При лечении добиваются следующих целей: облегчение симптомов заболевания (уменьшение гиперемии лица, количества папул и пустул), предотвращение прогрессирования, достижение длительной ремиссии, профилактика обострений, устранение косметического дефекта, улучшение качества жизни пациента [8].
Среди системных препаратов при розацеа широко применяют антибиотики тетрациклинового ряда и макролиды, которые регулируют воспалительный ответ путем угнетения продукции провоспалительных цитокинов (IL-1, фактор некроза опухоли), а также активных форм кислорода [10, 23]. Показана эффективность комбинированной терапии с использованием противовоспалительных доз доксициклина и топического метронидазола или азелаиновой кислоты для лечения больных с папуло-пустулезным подтипом розацеа [12].
В отечественной дерматологии метронидазол и другие препараты нитроимидазола широко назначают для терапии розацеа, в редких случаях прием препарата ассоциирован с эпилептиформными припадками, энцефалопатией, сенсорной нейропатией и другими нежелательными эффектами, сенсибилизирующим действием при употреблении алкоголя [15]. Управление по контролю качества пищевых продуктов и лекарственных средств (FDA, США) применение этих препаратов внутрь для лечения розацеа не санкционировало, тогда как одобрило топические препараты метронидазола (0,75 и 1 % лосьон, крем, гель), а также азелаиновую кислоту (15 % гель и 20 % лосьон) и натрия сульфацетамид (10 %) с добавлением серы (5 %) (крем, мазь, лосьон), бримонидин (0,33 % гель), ивермектин (1 % крем). Эффективность топических препаратов подтверждена рандомизированными клиническими испытаниями [18, 21, 24].
Согласно рекомендациям консенсуса Американского общества акне и розацеа и глобального розацеа-консенсуса (2013), препаратами первой линии в лечении папуло-пустулезной розацеа легкой и умеренной степени тяжести (или центрофациальной эритемы с воспалительными высыпаниями) являются топические метронидазол, азелаиновая кислота [10, 20]. При легкой степени розацеа рекомендуют использовать эти препараты в виде монотерапии, в случае умеренного или тяжелого течения лечение дополняют приемом внутрь антибиотиков или изотретиноина.
В последние годы накоплен успешный опыт применения крема «Розамет®» (Jadran, Хорватия) при лечении папуло-пустулезного подтипа в течение 3—8 нед.
Цель исследования — изучить эффективность различных вариантов применения крема «Розамет®» в составе комплексной терапии больных с папуло-пустулезным подтипом розацеа.
Материалы и методы
Под наблюдением находилось 40 пациентов в возрасте от 31 до 48 лет (26 женщин и 14 мужчин) с папуло-пустулезным подтипом розацеа, осложненным демодекозом в 27 случаях (D. folliculorum подтвержден лабораторно). Клиническая картина характеризовалась наличием изолированных или сгруппированных папул и пустул на фоне стойкой эритемы, телеангиэктазий на коже щек, подбородка и лба. Легкая степень тяжести дерматоза (менее 10 папул и/или папуло-пустул, легкая центрофациальная эритема) была у 17 больных, средняя (10—19 папул и/или папуло-пустул, умеренная центрофациальная эритема) — у 23 пациентов. Большинство больных жаловались на зуд, жжение, сухость кожи. Длительность заболевания у больных в среднем составляла от 1,5 до 8 лет. Ведущими факторами, провоцирующими обострения, были психо-эмоциональные стрессы, инсоляция, тепловые процедуры, применение косметических средств. Большинство пациентов ранее лечились амбулаторно. У больных выявлены вегетососудистая дистония, хронические заболевания пищеварительного канала, болезни сердечно-сосудистой системы.
Для оценки дерматологического статуса больных до лечения, через 1—5 и 6 мес от начала лечения применяли шкалу диагностической оценки розацеа (ШДОР) [1]. Она включает качественную оценку выраженности эритемы: 0 — ощутимой эритемы нет; 1 — слабая (легкая); 2 — умеренно выраженная; 3 — тяжелая (сильная); определение количества папул и пустул: 0 — менее 10; 1 — от 11 до 20; 2 — от 21 до 30; 3 — более 30; наличие телеангиэктазий: 0 — отсутствуют; 1 — занимают менее 10 % лица; 2 — от 11 до 30 %; 3 — более 30 %. Также оценивали второстепенные признаки: сухость кожи и шелушение: 0 — сухости нет; 1 — слабая; 2 — умеренная, с незначительным шелушением; 3 — сильная, с выраженным шелушением; субъективные ощущения (чувство жжения и покалывания кожи); наличие отека лица: 0 — нет; 1 — слабый; 2 — умеренный; 3 — сильный. У пациентов с розацеа легкой степени тяжести показатель ШДОР составил (6,4 ± 1,3) балла, средней степени тяжести — (10,5 ± 1,7) балла.
| Срок наблюдения | ШДОР, баллы | р | |
|---|---|---|---|
| 1-я группа (n = 21) | 2-я группа (n = 19) | ||
| До лечения | 8,5 ± 0,9 | 8,3 ± 0,9 | > 0,05 |
| В процессе лечения/наблюдения через: | |||
| 1 мес | 6,7 ± 0,0 | 6,6 ± 0,9 | > 0,05 |
| 2 мес | 3,9 ± 0,7 | 3,6 ± 0,6 | > 0,05 |
| 3 мес | 3,0 ± 0,6 | 4,2 ± 0,7 | < 0,05 |
| 4 мес | 1,9 ± 0,3 | 5,0 ± 0,7 | < 0,01 |
| 5 мес | 2,2 ± 0,4 | 6,1 ± 0,8 | < 0,01 |
| 6 мес | 2,5 ± 0,5 | 7,5 ± 0,9 | < 0,01 |
Примечание. р — достоверность отличий между показателями в группах больных.
Терапия больных розацеа легкой степени тяжести включала применение крема «Розамет®» 2 раза в сутки в течение 8 нед, умеренной степени тяжести — антибактериальные средства (доксициклин), препараты венотонизирующего и ангиопротекторного действия, назначаемые в течение 1,5 мес, крем «Розамет®» 2 раза в сутки в течение 8 нед.
Пациенты разделены на две группы в целях наблюдения и сравнения динамики процесса в случае продолжения наружного лечения и отмены. Больные 1-й группы (n = 21, легкая степень тяжести у 9, средняя — у 12) продолжали применять «Розамет®» раз в сутки в течение 8 нед. Пациенты 2-й группы (n = 19, легкая степень тяжести у 8, средняя — у 11) лечения не получали, находились под наблюдением.
Терапевтический эффект оценивали по ШДОР на основании динамики разрешения клинических симптомов и субъективных ощущений больных. Клиническую эффективность терапии оценивали с помощью следующих критериев: клиническое выздоровление — разрешение очагов поражения в виде полного отсутствия эритемы, телеангиэктазий, папулезных и пустулезных высыпаний; значительное улучшение — отсутствие новых высыпаний, регресс телеангиэктазий и папулезных высыпаний более чем на 50 %; улучшение — изменение указанных клинических критериев менее чем на 50 %; без эффекта — кожные проявления после лечения не изменились.
Данные обрабатывали c использованием программной системы Statistica for Windows 5.5. Критерием статистической достоверности выводов считали величину р < 0,05, где р — уровень статистической значимости.
Результаты и обсуждение
Комплексная терапия больных с розацеа папуло-пустулезным подтипом в течение 2 мес обусловила клиническое выздоровление у 9 (22,5 %), значительное улучшение — у 25 (62,5 %), улучшение — у 6 (15,0 %) пациентов, показатель ШДОР составил (2,7 ± 0,4), (3,8 ± 0,6) и (5,2 ± 0,7) балла соответственно.
Динамика кожного процесса — объективных и субъективных проявлений болезни (количество воспалительных элементов, телеангиэктазии, отек, эритема, жжение, сухость) под влиянием терапии отражена в табл. 1. Существенное снижение показателя ШДОР происходило на протяжении первых 2 мес терапии в 1-й и 2-й группах больных. Регресс или уменьшение количества папул и/или пустул, эритемы, отека отмечен у большинства пациентов к концу 8-й недели терапии, сохранялись телеангиэктазии и легкая эритема лица, единичные папулы, покалывание кожи (рисунок).
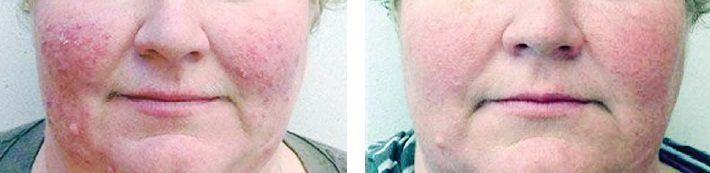
Рисунок. Больная розацеа (папуло-пустулезный подтип, средняя степень тяжести) до (слева) и через 8 нед лечения (справа)
Обращает внимание достаточно быстрый клинический эффект — первые симптомы улучшения наблюдались к концу 1-й недели терапии в виде снижения интенсивности эритемы, отечности и зуда кожи, к 12—14-м суткам уменьшились количество и размеры папуло-пустулезных высыпаний. Наибольшая выраженность клинического эффекта достигалась к 28—30-м суткам терапии, и к концу 2-го месяца оставались у 25 больных телеангиэктазии, единичные папулы, у 6 пациентов — папуло-пустулезные высыпания (менее 10), телеангиэктазии, жжение кожи. При дальнейшем наблюдении за больными розацеа выявили динамику клинических проявлений дерматоза при продолжении наружной терапии (2 мес) и отсутствии лечения (см. табл. 1). У пациенмов 1-й группы к концу 4 мес терапии оставались телеангиэктазии, сухость, периодическое покалывание кожи. Еще через 2 мес у них не выявлено явных признаков прогрессирования, но показатель ШДОР недостоверно увеличился. Пациенты 2-й группы, закончившие лечение, жаловались на усиление эритемы, появление новых единичных папул и/или пустул уже через 1 мес после отмены терапии, постепенное ухудшение процесса каждый месяц и развитие через 4 мес клинической картины, требовавшей повторного лечения (ШДОР (7,5 ± 0,9) балла).
| Группа | Степень тяжести | Рецидивы (количество) в периоды наблюдения | |||
|---|---|---|---|---|---|
| 3 мес | 4 мес | 5 мес | 6 мес | ||
| 1-я (n = 21) | Легкая (n = 9) | — | — | — | — |
| Cредняя (n = 12) | — | 2 | |||
| 2-я (n = 19) | Легкая (n = 8) | — | — | 1 | 2 |
| Средняя (n = 11) | — | 1 | 1 | 3 | |
У пациентов обеих групп проанализировано течение дерматоза после окончания терапии (табл. 2).
У больных 1-й группы, получавших наружную терапию в виде крема «Розамет®» в течение 4 мес, через 2 мес дерматоз рецидивировал только у 2 (9,5 %) со средней степенью тяжести, тогда как во 2-й через 1 мес после отмены терапии произошел рецидив у пациента со средней степенью тяжести, через 2 мес — у 2, к концу периода наблюдения — еще у 5 больных, в целом в 8 (42,1 %) случаях (у 3 больных с легкой степенью тяжести дерматоза и у 5 — со средней).
В связи с наличием или формированием чувствительной кожи у больных розацеа значимым является применение «легких» по текстуре кремовых основ наружных лекарственных форм, так как жирные и масляные основы ухудшают течение, вызывают эстетически неприемлемый блеск кожи лица. Именно такую гидрофильную основу используют в препарате «Розамет®» — 1 % метронидазол в виде крема. Следует отметить, что переносимость препарата «Розамет®» была хорошей, только 4 пациента отмечали незначительное жжение, слабый зуд, незначительное усиление эритемы в начале лечения. При этом явления разрешились самостоятельно на 4—6-е сутки применения крема. В дальнейшем пациенты хорошо переносили препарат даже при длительном применении. Больные отмечали отсутствие запаха, удобство применения, приятную текстуру препарата, возможность нанесения то нальных средств и декоративной косметики пос ле употребления лечебного крема, значительное улучшение настроения по мере разрешения элементов на лице.
На сегодня ни один метод терапии не гарантирует полного излечения от розацеа. Тем не менее длительное назначение топических препаратов или новых средств могут обеспечивать значительное улучшение состояния, недостижимое ранее.
Наиболее эффективными при папуло-пустулезной розацеа, согласно Кокрановского обзора 2015 года (оценка результатов рандомизированных контролируемых испытаний), оказались топические препараты метронидазола и азелаиновой кислоты, топический ивермектин [12, 19]. Новый препарат ивермектин обладает противовоспалительным и противоклещевым действием, эффективен при папуло-пустулезном подтипе, но в Украине его нет. Топические метронидазол и азелаиновая кислота эффективны, безопасны, имеют благоприятное соотношение стоимость/эффективность, в равной степени спо собствуют уменьшению воспалительных яв лений (эритема, количество папул и/или пус тул). Тем не менее побочные эффекты у пациентов, применявших метронидазол, наблюдались реже [12, 21].
Впервые возможность применения топического метронидазола при лечении больных розацеа показана в 1980-е гг. В ряде исследований доказана эффективность использования метронидазола (крем или гель) в течение 6—10 нед [2, 24]. В 2006 г. при сравнении эффективности крема, геля и лосьона метронидазола 0,75 и 1 % один или 2 раза в сутки в течение 8—16 нед не выявлено существенных различий при использовании различных форм препарата [24]. Нежелательные эффекты развиваются редко. Это сухость кожи, раздражение, зуд. Метронидазол является антипротозойным средством, воздействующим на D. folliculorum. Большую роль оказывает также бактериостатический эффект, механизм которого связан с нарушением структуры ДНК и блокированием синтеза нуклеиновых кислот чувствительных микроорганизмов, в том числе облигатных анаэробных бактерий (грамотрицательные анаэробные палочки, H. pylori и др.). Особенно важен при местном применении метронидазола дополнительный противовоспалительный эффект, достигаемый за счет снижения продукции реактивных форм кислорода, медиаторов воспаления при подавлении активности нейтрофилов комплексом, образуемым метронидазолом при совместном действии с ненасыщенными жирными кислотами кожи [2, 9, 17].
Применение крема «Розамет®», содержащего 1 % метронидазола, для лечения розацеа папуло-пустулезного подтипа в течение 8 нед обеспечил в 100 % случав положительный результат (85 % случаев — клиническое излечение и значительное улучшение, 15 % — улучшение). Показатель ШДОР за 2 мес терапии уменьшился у всех пациентов в 2,3 раза. У больных 1-й группы, продолживших наружное лечение, т. е. за 4 мес, средний балл снизился более значимо — в 4,4 раза. Во 2-й группе больных, прекративших лечение, ШДОР через 2 мес увеличился в 1,4 раза, через 4 мес –в 2,1 раза.
Наружная терапия кремом «Розамет®» обеспечивает регресс папуло-пустулезных высыпаний и, вероятно, способствует уменьшению отека и эритемы за счет влияния на медиаторы воспаления, единственной остаточной эритемой является расширение кровеносных сосудов (телеангиэктазии). Однако если контроль над эритемой сохраняется, развитие дальнейших телеангиэктазий может быть подавлено. Длительные ремиссии в конечном итоге уменьшают эритему до исходного уровня. Предполагают, что «новое» воспаление, папулы и пустулы усиливают эритему и отек и таким образом запускают порочный круг, ведущий к рецидиву дерматоза.
Применение стандартной фармакотерапии при розацеа позволяет достичь улучшения клинических проявлений болезни и добиться клинической ремиссии процесса, но часто вскоре наступают рецидивы и прогрессирование дерматоза. К сожалению, долгосрочные подходы к поддержанию контроля над розацеа недостаточно отражены в литературе. При этом лишь несколько исследований посвящены оценке наружной поддерживающей терапии [9]. Наш опыт свидетельствует, что продолжение наружной терапии еще в течение 8 нед (в целом 16 нед лечения) способствует уменьшению частоты рецидивов. После окончания лечения у 10 (25,0 %) больных развились рецидивы, при этом в 4 раза реже в 1-й группе (5,0 %), чем во 2-й (20,0 %).
В профилактике рецидивов и долгосрочном контроле розацеа значимая роль отводится также избеганию триггеров или уменьшению их воздействия, в частности ультрафиолетового из лучения, стрессов, алкоголя, резких перепадов температур, соблюдению диеты. Симптомо-комплекс чувствительной кожи у больных требует необходимого и соответствующего ухода. Для ухода за кожей пациентам рекомендованы специально разработанные линии косметевтических продуктов.
Выводы
Топический метронидазол 1 % (крем «Розамет®») является препаратом выбора при наружном лечении папуло-пустулезного подтипа розацеа, что подтверждают данные о высокой эффек тивности (85 % клиническое излечение и значительное улучшение) и хорошей переносимости препарата. При легкой степени тяжести рекомендуют применять крем в виде монотерапии, при средней — в составе комбинированной терапии в течение 8 нед. Применение 1 % крема «Розамет®» возможно в качестве поддерживающей длительно терапии при розацеа (не менее 8 нед).
Список литературы
- Адаскевич В.П. Диагностические индексы в дерматологии. — М.: Медицинская книга, 2004. — 164 с.
- Давыдова И.Б., Королева М.А., Чхатвал Н.А. Топическое применение 1 % крема розамет в комплексном лечении патологии кожи лица // Клин. дерматол. и венерол. — 2009. — № 4. — С. 69—71.
- Катунина О.Р. Функции Toll-подобных рецепторов как компонента врожденного иммунитета и их участие в патогенезе дерматозов различной этиологии // Вестн. дерматол. и венерол. — 2011. — № 2. — С. 18—25.
- Кубанова А.А., Махакова Ю.Б. Розацеа: распространенность, патогенез, особенности клинических проявлений // Вестн. дерматол. и венерол. — 2015. — № 3. — С. 36—45.
- Кутасевич Я.Ф., Маштакова И.А. Опыт топического применения метронидазола для комплексного лечения больных розацеа // Укр. журн. дерматол., венерол., косметол. — 2015. — № 3 (58). — С. 59—62.
- Молочков А.В., Овсянникова Г. Метронидазол в наружном лечении розацеа // Клин. дерматол. и венерол. — 2010. — № 2. — С. 82—84.
- Самоделкина К.А., Короткий Н.Г. Современные концепции этиологии и патогенеза розацеа // Клин. дерматол. венерол. — 2012. — № 2. — С. 4—8.
- Хайрутдинов В.Р. Розацеа: современные представления о патогенезе, клинической картине и лечении // Эффект. фармакотер. — 2014. — № 3. — С. 32—37.
- Dahl M.V., Katz H.I., Krueger G.G. et al. Topical metronidazole maintains remissions of rosacea // Arch. Dermatol. — 1998. — Vol. 134, N 6. — P. 679—683.
- Del Rosso J.Q., Thiboutot D., Gallo R. et al. Consensus recommendations from the American Acne & Rosacea Society on the management of rosacea, part 5: a guide on the management of rosacea // Cutis. —2014. — Vol. 93, N 1. — P. 134—138.
- Eckel R. Rosacea: the strawberry fields of dermatology // Prime J. — 2014. — Vol. 4, N 4. — P. 60—62.
- Elewski B.E., Draelos Z., Dréno B. et al. Rosacea — global diversity and optimized outcome: proposed international consensus from the Rosacea International Expert Group // J. Eur. Acad. Dermatol. Venereol. — 2011. — Vol. 25, N 2. — P. 188—200.
- Forton F.M. Papulopustular rosacea, skin immunity and Demodex: pityriasisfolliculorum as a missing link // J. Eur. Acad. Dermatol. Venereol. — 2012. — Vol. 26, N 1. — P. 19—28.
- Holmes A.D., Steinford M. Integrative concepts of rosacea pathophysiology, clinical presentation, and new therapeutics // Exp. Dermatol. — 2016. — Doi: 10.1111/exd.13143.
- Korting H.C., Schöllmann C. Current topical and systemic approaches to treatment of rosacea // J. Eur. Acad. Dermatol. Venereol. — 2009. — Vol. 23, N 8. — P. 876—882.
- Lacey N., Raghallaigh D. Ni, Powell S.F. Demodex mites-commensals, parasites or mutualistic organisms? // Dermatol. — 2011. — Vol. 222, N 2. — P. 128—130.
- Miyachi Y. Potential antioxidant mechanism of action for metronidazole: Implications for rosacea management // Adv. Therapy. — 2001. — Vol. 18, N 6. — Р. 237—243.
- Oge L.K., Muncie H.L., Phillips-Savoy A.R. Rosacea: diagnosis and treatment // Am. Fam. Physician. — 2015. — Vol. 92, N 3. — P. 187—196.
- van Zuuren E.J., Fedorowicz Z., Carter B. et al. In terventions for rosacea. Cochrane Database Syst // 2015.— 4.— CD003262. Doi: 10.1002/14651858. CD 003262. Pub. 5.
- Tan J., Almeida L., Bewley A. et al. Updating the diagnosis, classification and assessment of rosacea: recommendations from the global ROSaceaCOnsensus (ROSCO) panel // Brit. J. Dermatol. — 2017. — Vol. 176, N 2. — P. 465—471.
- Wolf J.E., Kerrouche N., Arsonnaud S. Efficacy and safety of once-daily metronidazole 1 % gelcompared with twice-daily azelaic acid 15 % gel in the treatment of rosacea // Cutis. — 2006. — Vol. 77 (4 Suppl.) — P. 3—11.
- Woo Y.U., Lim J.H., Cho D.H., Park H.J. Rosacea: molecular mechanisms and management of a chronic cutaneous in - flammatory condition // Int. J. Mol. Sci. — 2016. — Vol. 17, N 9. — P. 1562—1568.
- Yamasaki K., Gallo R.L. Rosacea as a disease of cathelicidins and skin innate immunity // J. Invest. Dermatol. Symp. Proc. — 2011. — Vol. 15, N 1. — P. 12—15.
- Yoo J., Reid D.C., Kimball A.B. Metronidazole in the treat ment of rosacea: do formulation, dosing, and concentration matter? // J. Drugs Dermatol. — 2006. — Vol. 5, N 4. — P. 317—319.
Рекомендовано
 Місце системних ретиноїдів в лікуванні розацеа
Місце системних ретиноїдів в лікуванні розацеа
У статті розглядаються питання патогенетичної терапії рожевих вугрів, що включає системні синтетичні ретиноїди. Наведено схеми лікування при різних формах розацеа. Читати >
 Досвід лікування тяжких форм вугрової хвороби
Досвід лікування тяжких форм вугрової хвороби
Викладено досвід лікування 39 хворих тяжкими формами вугрової хвороби за допомогою препарату групи системних ретиноїдів — ізотретіноїну LIDOSE. Продемонстровано його високу терапевтичну ефективність. Дано рекомендації щодо ведення та обстеження хворих, заходів щодо запобігання можливим побічним діям. Читати >
 Вульгарні акне: сучасні уявлення про етіологію, патогенез і терапевтичні можливості
Вульгарні акне: сучасні уявлення про етіологію, патогенез і терапевтичні можливості
Досліджували ефективність та безпечність використання препарату «Зеркалін®»для лікування хворих з папуло-пустульозною формою вульгарних акне. Обстежено 63 пацієнти з вульгарними акне та 28 здорових осіб віком від 14 до 25 років. Читати >
 Нові підходи в лікуванні середньотяжких форм акне із застосуванням препарату «Акнетин»
Нові підходи в лікуванні середньотяжких форм акне із застосуванням препарату «Акнетин»
Описано досвід застосування інноваційного системного ретиноїду «Акнетин» у комплексному лікуванні пацієнтів з вугровою хворобою середньої, середньотяжкої та тяжкої форм. Порівняльний аналіз наближених і віддалених результатів лікування та спостереження за 28 пацієнтами продемонстрував добру переносність і швидкий клінічний ефект препарату. Висока біодоступність препарату, зниження курсової кумулятивної дози на 20 %, повне клінічне одужання більшості пацієнтів дає підстави вважати лікування «Акнетином» при акне найефективнішим на сучасному етапі. Читати >
 Досвід терапії хворих з резистентними та тяжкими формами акне та розацеа з використанням системного ізотретиноїну LIDOSE
Досвід терапії хворих з резистентними та тяжкими формами акне та розацеа з використанням системного ізотретиноїну LIDOSE
Мета роботи — висвітлення досвіду терапії хворих з резистентними та тяжкими формами акне та розацеа з використанням індивідуальних доз системного ізотретиноїну LIDOSE. Читати >


