Новые подходы в лечении среднетяжелых форм акне с применением препарата «Акнетин»
К.В. Семенуха 1, Е.А. Ковальская 2, Е.А. Салей 2, О.К. Семенуха3, А.П. Ковальчук 2
1 ГУ «Днепропетровская медицинская академия»
2 Днепропетровская городская клиническая больница № 17
3 Днепропетровская центральная районная больница
Ключевые слова Угревая болезнь, системный изотретиноин, «Акнетин», экстрабиодоступность, эффективность
Угревая болезнь представляет весьма значительную медико-социальную проблему, для решения которой не существует эффективных методик. До 80 % молодежи в возрасте от 12 до 18 лет имеют различные формы акне, а среди молодых людей от 19 до 28 лет угревая болезнь встречается в 25 % случаев [1, 2, 5, 15, 22, 28].
Больные с акне устойчиво занимают первое место среди посетителей косметологических кабинетов и третье — в структуре посещаемости дерматологов [13].
В последние годы закрепилась тенденция к росту заболеваемости, ювенилизации процесса и увеличению количества среднетяжелых и тяжелых форм, не поддающихся традиционной терапии [20, 25, 30, 31].
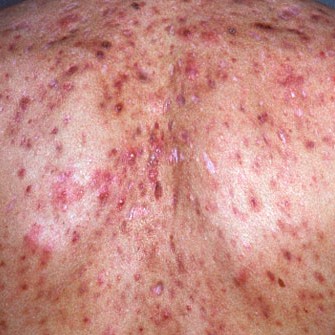
Драматичной для пациентов является преимущественная локализация процесса на лице и в области «пелерины», то есть на видимых частях тела, что приводит к прогрессирующей социальной дезадаптации молодого человека, формированию депрессивного синдрома и общественной изоляции. В период формирования личности, развития сложных коммуникативных процессов как в микро-, так и в макросоциуме, определения своей иерархической ступеньки в молодежном коллективе угревая болезнь резко снижает самооценку и не позволяет человеку, имеющему определенный потенциал, реализовать себя. В силу условностей, спровоцированных как болезнью, так и гипероценкой своего патологического статуса, видимого окружающим [17, 21, 23]. Отягощает ситуацию хронический рецидивирующий характер заболевания, тенденция к увеличению средних, среднетяжелых и тяжелых форм акне — конглобатных, нодулярно-кистозных и папуло-пустулезных форм, длительность процесса и торпидность к проводимой терапии, формирование постакне [6, 12, 21]. Кроме того, некоторые родители считают угри физиологическим статусом юношеской кожи, не требующим коррекции, и рекомендуют детям дождаться периода полного пубертатного созревания или начала активной сексуальной жизни в условиях брака, что приведет, по их мнению, к разрешению патологии.
Проблема акне сверхактуальна, распространена в обществе, социально значима и очень коррелирует с качеством жизни! Квалифицированный дерматолог просто обязан аргументированно и грамотно объяснить пациенту и его родственникам все аспекты патогенеза заболевания и возможности воздействия на его различные звенья, адекватность и эффективность методов, длительность терапии, возможность рецидива и окончательный прогноз. Но это возможно лишь при четком понимании многообразования механизма формирования угревой болезни, его вариабельности и полифакторности, прямой связи с гормональным и иммунологическим статусами, генетической предрасположенностью.
Основными звеньями патофизиологии акне являются четыре механизма:
- андрогенообусловленная гиперпродукция кожного сала, приводящая к гипертрофии сальной железы;
- ретенционный фолликулярный гиперкератоз, обусловленный изменением физико-химических свойств избыточно образующегося кожного сала;
- активация условно-патогенной флоры сально-волосяных фолликулов (Propionibacterium acnes, Staphyllococus aureus, Malassezia furfur, Demodex folliculorum), вызванная снижением бактерицидности кожного сала;
- вторичное воспаление, обусловленное активацией Propionibacterium acnes, в связи с гипервыработкой кожного сала, имеющего сниженную бактерицидность.
Гиперсекреция кожного сала является следствием высокого уровня андрогенов в крови, надпочечникового или гонадного (тестостерон) происхождения, и гиперчувствительности к ним сальных желез.
Гиперандрогения может быть временной (физиологической) — перед менструацией, или постоянной — вследствие заболеваний эндокринной или половой сферы. Иногда высокий уровень свободного тестостерона может быть следствием снижения концентрации глобулинов, которые синтезируются в печени и связывают до 65 % половых гормонов, причем концентрация в крови у женщин этого транспортного белка крови в два раза выше. Гиперсекрецию сальных желез провоцирует и повышение активности 5-редуктазы — фермента, являющегося непосредственным стимулятором синтеза кожного сала [19, 24, 32].
Важным провоцирующим фактором в формировании акне является усиление кератинизации фолликулярного канала за счет замедления отторжения эпителиоцитов. Соответствующее усиленное сцепление формируется за счет нарушения состава и выработки межклеточных липидов, а также недостаточной дезинтеграции десмосом эпителиоцитов в роговом слое. А нарушение нормального слущивания эпителиоцитов стимулирует ретенционный гиперкератоз, который, наряду с усилением сцепления корнеоцитов, приводит к закупорке протоков сальных желез роговыми массами и образованию комедонов [1, 18, 19, 20].
Таким образом создаются анаэробные условия, благоприятные для развития Р. acnes, которые являются микроаэрофильными бактериями. В связи с этим количество пропионбактерий в комедонах, особенно закрытых, многократно превышает содержание аэробных бактерий (кокков). Установлено, что Р. acnes синтезируют различные хемоатрактанты, проникающие через стенку интактного фолликула и притягивающие лейкоциты, что приводит к формированию перифолликулярного инфильтрата. Лейкоциты в присутствии антител к Р. acnes и комплемента высвобождают лизосомальные ферменты, повреждающие извне стенку фолликула. Пропион-бактерии синтезируют липазу, расщепляющую триглицериды кожного сала до достаточно агрессивных свободных жирных кислот, сквалена, сфингозина, липолевой кислоты, способных повредить стенку фолликула изнутри. Кроме того, сфингозин и сфингозилфосфорилхолин активизируют пролиферацию кератиноцитов, а ацетилированные формы сфинголипидов (церамиды) являются стимуляторами дифференцировки кератиноцитов [3].
Важна в понимании патогенеза и способность Р. acnes продуцировать целый ряд ферментов (протеазы, липазы, фосфолипазы, лецитиназы и ряда других), повреждающих фолликулярный эпителий, что приводит к непосредственному контакту содержимого комедона с окружающими тканями и провоцирует воспалительную реакцию, имеющую широкий клинический диапазон [17, 29].
Р. acnes непосредственно стимулируют воспалительную реакцию за счет индуцирования выработки мононуклеарными клетками провоспалительных цитокинов — ИЛ-8, ИЛ-1β и факторов некроза опухоли α. Кроме этого, пропионбактерии продуцируют гистаминподобные вазоактивные амины, а также синтезируют антигены, активно стимулирующие выработку антител [3, 23].
Однако есть много неясностей. Количество Р. acnes в патологических элементах не коррелирует с тяжестью клинической картины. Так, в комедонах и папуло-пустулах степень обсеменения пропионбактериями очень высокая, а в нодулокистозных элементах их количество минимально. Возможно, это обусловлено активным фагоцитозом Р. acnes клетками окружения и активной генерацией лейкоцитами активных форм кислорода, что губительно для анаэробных бактерий [1, 15, 29].
В то же время нужно различать Р. acnes как гетерогенные бактерии, на различных стадиях по-разному выделяющие биоактивные молекулы — экзимы и хемотаксины — и способные потенцировать местные воспалительные реакции.
Для дерматолога важно понимание того, что клеточная и гуморальная иммунная реакция макроорганизма определяет объем клинических симптомов и течение заболевания. Не бактерии являются детерминантным фактором заболевания, а реакция носителя. Адекватность реакций зависит от множества факторов, во многообразии своем и формирующих характерную клиническую симптоматику угревой болезни у конкретного пациента.
Конечно же, влияют пол и возраст, генетическая предрасположенность и типаж кожи, климат и особенности личной гигиены, характер питания и экзогенные раздражители. А также дисфункция системы гипоталамус — гипофиз — половые железы, дисбаланс эндокринной системы различного генеза у мужчин и женщин, поликистозы яичников, пред- и постменструальные дисгормональные стрессы, поздние, в том числе и постменструальные акне, дисбаланс андрогенов и эстрогенов в коже мужчин с акне [9, 17].
Важное значение в патогенезе угревой болезни имеет и нарушение функции печени, что проявляется разной степени гиперлипидемией, относительной гиперхолестеринемией и гипо-β-липопротеидемией, коррелирующей с тяжестью патологического процесса в коже [13, 20, 25].
И, конечно же, грамотный дерматолог увязывает выраженность клиники акне с нарушением микрофлоры кишечника. Условно-патогенные микроорганизмы проникают через гистогематогенные барьеры в кровеносное русло, что приводит к формированию и поддержанию вторичных очагов инфекции. Дисбиотические изменения в кишечнике приводят к формированию негативных микроэкологических условий для клеток макрохозяина, в результате чего на фоне иммуносупресии происходит усиление общевоспалительных и аллергических реакций, в том числе и клинических проявлений акне [4].
Вопросы патогенеза угревой болезни многовекторны, сложны для однозначной трактовки и восприятия, вариабельны в процессе развития, требуют квалифицированного глубокого изучения и адекватного восприятия, исключают догматику и требуют от врача осмысленного и индивидуального этиопатогенетического подхода.
Для угревой болезни характерен полиморфизм морфологических элементов сыпи, среди которых выделяют:
- первичные невоспалительные;
- вторичные воспалительные [1];
- третичные поствоспалительные.
| Степень | Комедоны (закрытые или открытые) | Папулы, пустулы | Узлы, кисты | Воспаление | Рубцы, пигментные изменения, келоиды | Психо-социальные осложнения |
|---|---|---|---|---|---|---|
| I (легкая) | Мало (менее 10) | Папулы менее 10 | Нет | Нет | Нет + |
+ |
| II (средняя) | Много (10—25) | Папулы (10—20), единичные пустулы | Нет | Выраженное | Нет ++ |
+ |
| III (тяжелая) | Много (26—50) | Папулы, пустулы (21—30) | Менее 5 | Сильное | ++ +++ + |
++ |
| IV (очень тяжелая) | Очень много (более 50) | Очень много (более 30) | Более 5 | Очень сильное | +++ +++ ++ |
+++ |
Информативна и удобна для установления правильного диагноза современная классификация, предложенная Американской академией дерматологии (таблица) [3].
Разделение пациентов в зависимости от распространенности и тяжести патологического процесса позволяет более дифференцированно и аргументированно подбирать для пациентов различные типы системной терапии. Именно больные третьей и четвертой групп наиболее часто имеют деструктивные типы поражения кожи с преобладанием узловато-кистозных, абсцедирующих, конглобатных, колликвативных, келоидных и рубцующихся элементов, что представляет серьезную психосоциальную и экономическую проблему для человека и выдвигает комплекс тактических задач и стратегических вопросов для лечащего врача. Особенно в условиях XXI века, когда внешний вид человека является его коммуникативной визитной карточкой, свидетельствующей о благополучии, здоровье и открытости для адекватного общения с миром.
Грамотный дерматолог, оценив ситуацию и собрав тщательный анамнез, может и должен разработать, предложить пациенту комплексную методику индивидуального лечения, учитывающую все звенья этиопатогенетического патологического процесса и отличающуюся высокой эффективностью.
Для лечения акне легкой степени тяжести применяют диетический режим, санацию очагов фокальной патологии, коррекцию дисбиоза кишечника, витаминотерапию в сочетании с правильным уходом за кожей, использованием антибактериальных и противовоспалительных средств, комбинированных препаратов локального воздействия, космецевтиков [2, 9]. При легко-средних и средних формах добавляют системные антибиотики и эубиотики, антибактериальные препараты и комбинированные оральные контрацептивы, топически можно использовать изотретиноин [5, 10, 16].
А что делать при средних, среднетяжелых и тяжелых формах угревой болезни, когда пациент побывал не у одного дерматолога и косметолога, получал неоднократно системные антибиотики и комбинированные препараты, использовал все топические моно- и комбинированные антибактериальные средства — и все это с кратковременным эффектом, а иногда — и без него?
На фоне конглобатных, узловато-кистозных или абсцедирующих угрей с выраженным постакне — рубцеванием и келоидизацией — с поражением лица, а чаще и верхней части туловища у пациента формируется устойчивое недоверие к возможностям современной медицины, пропадает вера в выздоровление. Развивается многовекторный депрессивный синдром с резко сниженной самооценкой и изоляционистскими устремлениями, усугубляющий течение основного заболевания. А если это состояние смоделировать на ожидание выпускного вечера в школе, начало студенческой жизни, ожидание новой успешной работы или любовные переживания… Дерматовенеролог, если он профессионал, обладает знаниями психо-терапевта, позволяющими аргументированно объяснить и убедить пациента в перспективности лечения и реальной возможности выздоровления.
Именно опыт лечения таких пациентов и представлен в этой работе. Опыт комплексного лечения больных со средней, среднетяжелой и тяжелой формами угревой болезни с применением современного системного ретиноида — препарата «Акнетин», производимого по инновационной запатентованной технологии Lidose, биодоступность которого на 20 % выше обычного изотретиноина, а курсовая кумулятивная доза снижена со 150 до 90—120 мг [7, 8].
Препарат производит в Бельгии компания «СМБ Технолоджи СА», а в Украине его представляет хорватская фармацевтическая компания «Ядран» в рамках стратегического партнерства.
Системные ретиноиды украинские дерматологи применяли и ранее. Монополистом изотретиноина являлась фирма «Хоффманн Ля Рош» с препаратом «Роаккутан». Препарат эффективно действовал при тяжелых формах угревой болезни, но необходимость достижения высокой кумуляционной дозы — 150 мг, низкая биодоступность (характерная для изотретиноина), ряд выраженных побочных эффектов и высокая стоимость делали его применение ограниченным [11, 12, 14, 26, 27].
Появление «Акнетина», разработанного с целью повышения биодоступности изотретиноина, уменьшения межсубъективной вариабельности при применении, снижения вероятности развития побочных эффектов и уменьшения общей кумулятивной дозы до 90—120 мг, предоставило дерматологам Украины реальный шанс помочь тысячам сложных пациентов, отчаявшихся когда-либо решить свою проблему [7, 8].
Препарат выпускают в капсулах по 8 и 16 мг.
Используя современную технологию Lidose в производстве новой формы препарата, удалось добиться увеличения процента растворенной фракции изотретиноина в капсуле на 13,5 % в сравнении с обычной формой. Это привело к повышению биодоступности препарата «Акнетин» на 20 % и позволило снизить разовую и курсовую дозы изотретиноина [7, 8].
Низкая биодоступность изотретиноина после приема внутрь объясняется его плохой растворимостью в водной среде. «Акнетин» — это суспензия изотретиноина в жировых наполнителях, которая содержит две фракции: растворенную (часть активного вещества растворена в смеси амфильных наполнителей, обладающих как гидрофильными, так и липофильными свойствами) и нерастворенную (взвешенные частицы в смеси наполнителей). Чем выше растворенная фракция изотретиноина в наполнителях, тем больше его биодоступность. Именно поэтому инновационная лекарственная форма Lidose содержит жировые наполнители, способные частично растворить изотретиноин и повысить его биодоступность.
Новая технология позволила получить стабильную форму главного действующего вещества — изотретиноина, ведь его значительная часть находится в растворенном виде. При контакте с водой капсулы «Акнетина» происходит быстрое ее растворение и высвобождение плотного жирового содержимого с последующей диффузией изотретиноина.
После высвобождения растворенная фракция изотретиноина благодаря содержанию амфифильного наполнителя (гелюцира) и поверхностно-активного вещества (СПАН) образует тонкодисперсную эмульсию с высоким показателем растворения действующего вещества в водной среде пищеварительного канала [7, 8].
При использовании технологии Lidose растворенная часть изотретиноина в «Акнетине» составляет около 54 % в отличие от 40 % обычного изотретиноина. Вследствие увеличения доли растворенного препарата, доступного для всасывания, повышается биодоступность изотретиноина при приеме внутрь, что позволяет достичь эквивалентного плазменного уровня действующего вещества в более низкой дозе. Достоверные сравнительные фармакологические исследования подтверждают, что после однократного приема 8 и 16 мг «Акнетина» уровень действующего вещества в плазме аналогичен таковому для 10 и 20 мг (соответственно) обычного изотретиноина. В результате сравнительных рандомизированных перекрестных исследований биодоступности «Акнетина», содержащего меньшую дозу действующего вещества и обычной формы изотретиноина, при условии однократного и множественного приема препарата доказана их биоэквивалентность, даже при меньшем на 20 % курсовом приеме «Акнетина». Таким образом, высокая эффективность и экстрабиодоступность нового препарата «Акнетин» обусловлена применением инновационной запатентованной технологии Lidose — лекарственной формы «твердого раствора», или «твердой дисперсии», сочетающей свойства твердой оболочки с характеристиками усвояемости жидкой формы [7, 8].
Усвояемость «Акнетина» гораздо менее зависима от приема с пищей, что позволяет повысить эффективность терапии при погрешностях в диете. А благодаря меньшему содержанию неактивной фракции изотретиноина, которая присутствует в желудочно-кишечном тракте при приеме препарата снижается риск возникновения и степень проявления побочных эффектов со стороны пищеварительного канала [3].
Назначение системного ретиноида пациентам с угревой болезнью требует четко аргументированного и высокопрофессионального подхода, соблюдения этапности диагностики и комплексного обследования, грамотной разъяснительной работы с пациентом и его родственниками. Больной должен знать, что изотретиноин — это стерео-изомер трансретиновой кислоты (третионина). Он эффективно угнетает активность сальных желез с гистологично подтвержденным уменьшением их размеров (до 90 %). Кроме этого, изотретиноин обладает мощным противовоспалительным и антихемотоксичным действием на дермальном уровне. Препарат ингибирует пролиферацию себоцитов и способствует их дифференцированию в кератиноциты. Он влияет на рост и нормализует секрецию кожного сала, способствует его своевременной эвакуации, являясь мощным комедолитиком. Поэтому способен блокировать воспалительный процесс на самых ранних стадиях формирования комедонов в коже, препятствуя развитию воспалительных папул и пустул. Учитывая, что подкожная клетчатка и дерма являются главным субстратом для развития Propionbacterium acnes, изотретиноин активно уменьшает колонизацию и опосредованно подавляет их рост и генерацию провоспалительных медиаторов, воздействуя тем самым на все патогенетические факторы заболевания [5, 11, 12, 14, 16].
Материалы и методы
Под наблюдением находились 28 больных (12 мужчин и 16 женщин в возрасте от 16 до 27 лет) с угревой болезнью средней, среднетяжелой и тяжелой степени выраженности.
До начала терапии все пациенты прошли комплексное клинико-лабораторное обследование в соответствии с приказом МОЗ Украины №312 от 08.05.2009 г. «Про затвердження клінічних протоколів надання медичної допомоги хворим на дерматовенерологічні захворювання», включавшее общеклинические исследования крови и мочи, биохимический анализ крови с определением общего билирубина, триглицеридов, АЛТ, АСТ, холестерина, щелочной фосфатазы, креатинина. Обязательным было определение уровня глюкозы в крови, проведение ультразвуковой диагностики состояния гепатобилиарной системы. 9 пациентов с тяжелой формой угревой болезни и давностью заболевания более пяти лет проконсультировал психотерапевт для определения психосоматического статуса и возможности терапии системными ретиноидами.
Кроме этого, все женщины, начинающие прием «Акнетина», прошли тест на беременность и начали принимать, по согласованию с гинекологом, гормональне контрацептивы за месяц до начала системной терапии.
Результаты и обсуждение
Терапевтическая эффективность препарата и вероятность развития побочных действий зависят от дозы и варьируют у различных больных. Поэтому подбор дозы был индивидуален в каждом конкретном случае. Лечение начинали с 32 мг/сут — по 16 мг 2 раза, что в среднем, учитывая разницу в массе тела пациентов, составляло от 0,4 мг до 0,7 мг на 1 кг в сутки. У 5 пациенток со средней степенью угревой болезни и весом 48—55 кг лечение начали с 24 мг/сут — 16 мг утром и 8 мг вечером, что составило 0,4—0,5 мг на 1 кг в сутки.
У 12 (43 %) пациентов на 10—16-й день приема «Акнетина» появились новые единичные пустулы — за счет резкого уменьшения размеров сальной железы и выброса секрета на поверхность кожи. Больные были заранее предупреждены о возможности такого процесса и его физиологичности. Через 2—4 дня эти патологические элементы регрессировали у всех пациентов.
Состояние пациентов контролировали каждые две недели, дозу индивидуально корректировали каждому больному в зависимости от давности и тяжести процесса, келоидизации и рубцевания, конглобатизации и узловато-кистозных образований, массы тела и психосоматических симптомов, возможных первичных побочных эффектов (особенно сухость кожи и слизистих оболочек, высокая фоточувствительность, дискомфорт со стороны пищеварительного тракта).
Больные со среднетяжелыми и тяжелыми формами угревой болезни получали «Акнетин» по 0,4—0,6 мг на 1 кг массы тела в течение 20—28 нед. Пациенты со средними формами акне принимали меньшую суточную дозу с постепенным уменьшением при необходимости до 16 мг/сут (до 0,3 мг на 1 кг), что, на наш вигляд, позволяло достаточно уверенно проводить эффективную терапию с минимальным риском развития побочных эффектов.
У 21 пациента (75 %) в процессе приема «Акнетина» отмечались явления хейлита, а у 16 (57 %) — ксероз различной выраженности. Развитие незначительной эритемы и шелушение кожи лица, открытых участков тела, а особенно тыльных поверхностей кистей и предплечий — следствие гипервитаминоза А, одним из проявлений которого является ретиноидный дерматит.
Все пациенты заранее были предупреждены о возможности таких реакций кожи и своевременно получили адекватные наружные смягчающие и фотозащитные средства. В таком случае проявления ретиноидного дерматита имели транзиторный характер, с более легким течением, являясь своеобразным маркером для контроля над выбранной дозой, а не поводом для ее снижения.
Исследование проводили весной — осенью 2011 года, поэтому профилактика фотодерматитов и ретиноидных ксерозов, спровоцированных солнечным и жарким летом, была особенно актуальной. Эффективным средством профилактики проявлений гипервитаминоза А на коже являлось обязательное использование увлажняющих защитных наружных средств. Для ежедневного ухода за чувствительной проблемной кожей и профилактики обострений рекомендованы очищаючие средства с нейтральным уровнем рН в виде пенки или геля, мусса. С целью стабилизации гидролипидной мантии применяли легкие по консистенции увлажняющие кремы и гели, обладающие мягким себокераторегулирующим и успокаивающим действием. Постоянно и многократно пациенты использовали гигиенические помады.
Обеспечивая защиту от ультрафиолетовых лучей, обращали внимание не только на фактор фотозащиты, но и на состав и консистенцию средства. Степень защиты фильтра (SPF, IPD, PPD) должна быть не менее 50. Важна и степень защиты кожи от воздействия ультрафиолетовых лучей типа А, а также показатель критической длины волны (должен быть выше 370 нм). Выбирая адекватный фильтр, мы обращали внимание на состав, содержащий физические и химические факторы защиты, антиоксиданты, противовоспалительные вещества без комедогенного эффекта.
Учитывая постоянную разъяснительную работу, профилактические меры по уменьшению проявлений ретиноидного дерматита и хейлита, большинство пациентов адекватно и ответственно отнеслось к сопутствующей терапии, но у 5 больных (18 %) в летнее время возникла необходимость временного снижения суточной дозы (с 32 до 24 мг — у 3, с 24 до 16 мг — у 2), что было вызвано активным проявлением гипервитаминоза А. Необходимо отметить, что в основном это были девушки с массой тела 48—53 кг, нордическим типом гиперчувствительной кожи, гипотонией. Снижение дозы системного ретиноида быстро вызывало нормализацию состояния. Более тщательный подбор средств для ухода и увлажнения кожи позволял через 3—5 недель выйти на предыдущий уровень «Акнетина» и продолжать терапию в полном объеме.
Имея богатый опыт применения системных ретиноидов, мы ожидали от терапии «Акнетином» широкой гаммы побочных действий со стороны пищеварительного канала [11, 12, 14, 21, 26]. Поэтому до начала терапии все пациенты были обследованы на наличие очагов фокальной патологии у гастроэнтеролога и получили необходимые рекомендации.
Кроме этого, все больные одновременно с изотретиноином получали современный гепатопротектор и пробиотик, дозы которых корректировались индивидуально. Мы акцентируем внимание на том, что при приеме «Акнетина» значительных и манифестных клинических симптомов дисфункции со стороны желудочно-кишечного тракта у пациентов не было! У 3 (11 %) больных отмечались незначительные жалобы на тошноту в первый месяц приема, а у 2 (7 %) — незначительные проявления изжоги в первый месяц. Эти симптомы были кратковременны и не требовали назначения дополнительных препаратов или снижения дозы ретиноида.
Следует отметить, что в процессе лечения особое внимание уделяли психосоматическому статусу пациентов, их стабильности, адекватности поведенческих реакций, склонности к депрессии и объективности оценки изменений своего физического статуса. Ведь еще M. Zulzberger и A. Zaidens в 1949 году писали: «Вероятно, нет такого другого заболевания, которое вызвало больше психического стресса, непонимания между детьми и родителями, больше общей неуверенности в себе, а также множество психических страданий, как acne vulgaris» [1].
Большинство больных, участвовавших в исследовании, давно и практически безрезультатно лечились по поводу среднетяжелых форм угревой болезни, что привело к изменению их поведенческих и формированию депрессивно-изоляционистского синдрома [2, 15, 20, 22, 23, 24, 25, 28, 32]. Поэтому начало улучшения состояния кожи, наступившее у большинства через 3—4 недели после начала приема «Акнетина», было позиционировано как начало «необратимого» процесса выздоровления, где пациент из состояния бесстрастного наблюдателя за очередной попыткой лечения убежденно и активно становился на сторону врача.
Этот постоянный диалог очень важен в смысле как формирования дальнейшей врачебной тактики и стратегии, так и вывода пациента из индивидуальной депрессии, постепенного возвращения надежды на исцеление и последующей микро- и макросоциальной реабилитации.
После 2—2,5 месяца терапии разрешалось до 80—90 % патологических элементов. На этом этапе лечения важно было очень четко и конкретно объяснить больному и его родственникам обязательность дальнейшего применения «Акнетина» с достижением кумулятивной курсовой дозы, индивидуальной для каждого пациента.
Это один из самых сложных моментов во взаимоотношениях с больным угревой болезнью. Пациент видит прекрасный эффект 2—3-месячной терапии — новые патологические элементы не появляются, старые быстро регрессируют и рассасываются, постакне и рубцы разрешаются. Так зачем же принимать дальше этот препарат с длинной аннотацией, перечисляющей все возможные побочные действия?!
И именно в этот период лечения дерматолог-профессионал должен аргументировано убедить пациента в необходимости полноценной курсовой терапии с обязательным достижением индивидуально подобранной кумулятивной дозы. Только это может привести к высокой вероятности полного излечения.
Все 28 пациентов с угревой болезнью прошли полный курс комплексной терапии с применением «Акнетина», кумулятивную курсовую дозу которого подбирали индивидуально. Для нас был важен опыт применения «Акнетина» у 5 пациентов со средней формой тяжести акне. Больные не имели столь выраженной клинической симптоматики, необходимой для назначения системных ретиноидов, но их анамнестические данные, психоэмоциональный фон с явлениями личностной и социальной дезадаптации позволил провести этим пациентам индивидуальный курс лечения «Акнетином» с коррекцией как разовой, так и курсовой доз. 5 пациентов со средними формами акне получили от 80 до 90 мг на 1 кг массы тела; 12 больных со среднетяжелыми формами акне получили кумулятивную форму — 90—105 мг; 6 пациентам со среднетяжелыми формами акне и выраженным постакне принимали по 100—110 мг/кг, а 5 пациентам с тяжелыми акне, поражением лица и туловища, выраженными постакне была назначена доза 110—115 мг/кг массы тела.
Эффективность лечения мы оцениваем как очень высокую. У всех пациентов со средними и среднетяжелыми формами акне и у 3 больных с тяжелыми формами угревой болезни отмечалось клиническое излечение — 27 пациентов (96 %). В одном случае тяжелой формы угревой болезни — кистозно-атероматозные проявления с поражением лица и верхней половины туловища, келоидизацией и выраженным постакне, давностью процесса более 5 лет и выраженным депрессивным синдромом — лечение оказало выраженный эффект и привело к улучшению состояния на 85—90 % (по общему мнению врача и пациента). Возможно, этому больному необходимы дальнейшие комплексные реабилитационные мероприятия, включающие как вариант дополнительный курс терапии «Акнетином» для достижения кумулятивной дозы — 120—130 мг/кг массы тела.
Особенностью действия «Акнетина» следует отметить быстрый и устойчивый регресс патологических элементов уже с 3-й недели применения, значительное улучшение рельефа кожи после 6—7 недель лечения и полное отсутствие каких-либо признаков воспаления в коже и ее придатков уже к 9—12-й неделе приема с восстановлением кожи и разрешением постакне. Позитивный эффект лечения имел быстрый и необратимый характер, без различных рецидивов, с применением минимального количества препаратов для системной и топической терапии. В процессе нарастания позитивных сдвигов физическое и психоэмоциональное самочувствие пациентов радикально улучшалось, явления депрессии, дисморфофобии и социальной дезадаптации быстро регрессировали. И, что очень важно, после завершения терапии 25 (89 %) пациентов были настолько удовлетворены полученным результатом разрешения постакне, что отказались от сложной многоэтапной реабилитации у косметологов, вооружившись рекомендациями по уходу за кожей, полученными у лечащего врача.
Комплексное лабораторное обследование пациентов, прошедших курс лечения системным ретиноидом «Акнетин» не выявило значительных изменений состояния систем и органов. Так, у 4 больных (14 %) выявлено незначительное повышение уровня трансаминаз, а у 3 (10 %) — повышение липидов сыворотки крови, что относится к полностью обратимым дозозависимым показателям. При повторном обследовании через две недели все показатели пришли к биологической норме.
Таким образом, каких-либо значительных побочных эффектов «Акнетина» не выявлено. Пациенты переносили препарат хорошо, комплаентность терапии была на высоком уровне. Новая инновационная технология изготовления Акнетина Lidose доказала свою экстрабиодоступность, что позволило снизить суточную и курсовую дозу на 20—25 % со значительным уменьшением количества побочных эффектов и сохранением высокой эффективности лечения.
Стоимость курса лечения «Акнетином» не всегда однозначно воспринимает пациент, а иногда и доктор. Ведь речь идет о длительном приеме препарата с обязательным набором кумулятивной дозы. А еще некоторые пациенты не различают названий препаратов, имея информацию о предыдущих изотретиноинах и всем спектре их побочных действий!
И здесь у дерматолога возникает дилемма… Либо предлагать пациенту лечиться достаточно долго, применяя и постоянно меняя различные системные антибиотики и многочисленные вспомогательные препараты с целым комплексом местной терапии и разнообразными косметическими процедурами, с ожиданием очередного неизбежного рецидива на фоне усиливающейся депрессии пациента. Суммарно финансовые, временные и психологические затраты будут несоизмеримо выше и, что самое главное, в большинстве случаев мы не сможем говорить о выздоровлении пациента. Либо рекомендовать «Акнетин» — препарат с высокой эффективностью, с хорошей переносимостью при правильном применении и быстрым, а в подавляющем большинстве случаев и необратимым клиническим эффектом.
Следует отметить, что «Акнетин» производится в Бельгии в соответствии с мировыми стандартами качества GMP, но при этом он доступнее по стоимости, чем присутствующий в Украине препарат обычного изотретиноина. Это стало возможным благодаря инновационной технолигии Lidose. Экономическая целесообразность применения стала более привлекательной.
Выводы
Анализируя данные, полученные в результате лечения 28 пациентов «Акнетином», сопоставляя их с более ранним опытом применения изотретиноинов, можно сделать вывод о появлении на отечественном рынке европейского качественного и современного препарата изотретиноина с большей биодоступностью. А снижение разовой и курсовой кумулятивной доз на 20 % при сохранении клинической эффективности позволяет говорить о новом инновационном подходе к лечению средних и среднетяжелых форм угревой болезни.
Список литературы
- Адаскевич В.П. Акне и розацеа.— СПб: Ольга, 2000.— 130 с.
- Аравийская Э.Р. Современная комплексная терапия акне и розацеа — задача специалиста / Тез. научн. раб. IX Всерос. съезда дерматовенерол.— М., 2005.— Т. 1.— С. 89.
- Волкова Е.Н., Осипова Н.К., Григорьева А.А., Платонов В.В. Прогрессивные технологии ведения больных с угревой болезнью и постакне // Укр. журн. дерматол., венерол., косметол.— 2010.— № 3 (38).— С. 89—94.
- Дюдюн А.Д., Резніченко Н.Ю. Застосування системних пробіотиків — шлях до покращання лікування вугрової хвороби // Дерматовенерол., косметол., сексопатол.— 2007.— № 1—4 (10).— С. 98—102.
- Дюдюн А.Д., Полион Н.Н., Захаров В.К. и др. Эффективность применение препарата «Изотрексин» гель в лечении больных угревой болезнью // Дерматовенерол., косметол., сексопатол.— 2009.— № 1—2 (12).— С. 333—337.
- Европейское руководство по лечению дерматологических заболеваний / Под ред. А.Д. Кацамбаса, Т.М. Лотти. — 2-е издание.— М.: МЕДпресс-информ, 2009.— 732 с.
- Исследование SBM-ISO-SD 011, Бельгия.
- Исследование SBM-ISO-SD 013, Франция.
- Клименко А.В., Степаненко В.І. Сучасна терапія при різних клінічних формах вугрової хвороби (акне) і акнеподібних дерматозах (розацеа, демодекоз та раціональні діагностичні й лікувальні заходи з підвищення її ефективності // Укр. журн. дерматол., венерол., косметол.— 2008.— № 3 (30).— С. 46—57.
- Кочан Б.Г., Терлецкий В.Б., Терлецкий Р.В. Азитромицин в лечении угревой болезни // Укр. журн. дерматол., венерол., косметол.— 2005.— № 2 (17).— С. 57—59.
- Кубанова А.А., Масюкова С.А., Саламова И.В. Применение ретиноидов в дерматологи / Мат. симпозиума.— Казань, 1996.— С. 13—14.
- Машкилейсон А.Л., Гомберг М.А., Роаккутан в клинике кожных болезней // Вестн. дерм. и венерол.— 1996.— №5.— С. 33—36.
- Молочков В.А., Семенова Т.Б., Молочков А.В., Корнева Л.В. Акне: клиника, диагностика, лечение: Учебное пособие.— М., 2006.— С. 37.
- Молочков В.А., Романенко Г.Ф. и др. Роаккутан в комплексном лечении флегмонозных и конглобатных угрей // Рос. журн. кожн. и венер. болезней.— 2000.— № 1.— С. 51—53.
- Потекаев Н.Н. Акне (угревая болезнь): современный взгляд на проблему // Дерматология.— 2008.— № 1.— С. 12-б.
- Проценко Т.В., Лебединская Л.А., Проценко О.А. «Изотрексин» в комплексном лечении при угревой болезни // Укр. журн. дерматол., венерол., косметол.— 2008.— №3 (30).— С. 64—65.
- Литус И.В. Опыт лечения угревой болезни роаккутаном в сочетании со скинореном // Журн. дерматол. и венерол. — 2000.— № 2 (10).— С. 76—79.
- Проценко Т.В. Местная терапия acne vulgaris с применением фиксированных комбинаций лекарственных средств (обзор литературы) // Укр. журн. дерм., венер., косметол.— 2010.— № 1 (36).— С. 55—63.
- Резниченко Н.Ю., Дюдюн А.Д. Сучасні аспекти етіопатогенезу вугрової хвороби // Дерматовен., косметол., сексопатол.— 2007.— № 1 (10).— С. 169—174.
- Самцов А.В. Акне и акнеформные дерматозы // Монография.— М.: ООО «ЮТКОМ», 2009.— 288 с.
- Степаненко В.І., Клименко А.В. Акне та акнеподібні дерматози (розацеа, демодекоз): стратегія комплексної етапної терапії // Клінічна імунол., алергол., інфектол.— 2010.— № 1.— С. 86—96.
- Шупенько О.М. Сучасні погляди на проблему вугрової хвороби та перспективні шляхи подальшого дослідження патогенезу цього дерматозу // Дерматовенерол., косметол., сексопатол.— 2009.— № 1—2 (12).— С. 121—134.
- Цепколенко В.А., Маврова Д.И. Современные подходы к патогенезу и лечению угревой болезни // Дерматол. та венерол.— 2007.— № 4 (38).— С. 41—44.
- Федотов В.П., Святенко Т.В. Акне: теорія и практика // Дерматовенерол., косметол., сексопатол.— 2006.— № 1—2 (9).— С. 80—85.
- Юцковская Я.А. Терапия угревой болезни разной степени тяжести. Проблемы дерматовенерол. и мед. космет. на современном этапе: Сб. работ ІІІ краевой науч.-практ.конф.— Владивосток, 2005.— Вып. № 7.— С. 234.
- Amichai S. et al. Low-dose isotretionin in the treatment of acne vulgaris // J. Am. Acad. Dermatol.— 2008.— Vol. 58. — Р. 56—59.
- Brecher A.R., Orlow S.J. Oral retinoid therapy for dermatologic conditions in children and adolescents // J. Am. Acad. Dermatol.— 2003.— Vol. 49.— P. 171—182.
- Collier Ch., Harper J., Cautrell W. The prevalence of acne in adults 20 years and older // J. Am. Acad. Dermatol.— 2008. — Vol. 58.— Р. 56—59.
- Mouser P.E., Baker B.S. et al. Propionbacterium acnes — reactive Thelper1 cells in the skin of patient with acne vulgaris // J. Invest. Dermatol.— 2003.— Vol 121.— P. 1226—1228.
- Plewig G., Kligman A. Acne and rosacea, 3rd ed.— Berlin: Springer, 2002.
- Ross J.I., Snelling A.M., Carnegie E. et al. Antibiotic-resistant acne: Lessons from Europe // Br. J. Dermatol.— 2003.— Vol. 148.— P. 467—478.
- Zouboulis C.C., Eady A., Philpott M. et al. What is the pathogenesis of acne? // Exp. Dermatol.— 2005.— Vol. 14. — P. 143—152.
Рекомендовано
 Место системных ретиноидов в лечении розацеа
Место системных ретиноидов в лечении розацеа
Розацеа — хроническое рецидивирующее заболевание сальных желез и волосяных фолликулов кожи в сочетании с повышенной чувствительностью капилляров дермы к различным триггерным факторам. Читать >
 Опыт лечения тяжелых форм угревой болезни
Опыт лечения тяжелых форм угревой болезни
Обыкновенные угри (Acne vulgaris) — хроническое заболевание аппарата сальных желез, которое преимущественно манифестирует в пубертатном периоде и характеризуется гиперпродукцией кожного сала, нарушением процессов фолликулярной кератинизации, колонизацией Propionibacterium acnes и воспалением. Читать >
 Вульгарные акне: современные представления об этиологии, патогенезе и терапевтических возможностях
Вульгарные акне: современные представления об этиологии, патогенезе и терапевтических возможностях
Проведено исследование эффективности и безопасности применения препарата «Зеркалин®»в лечении больных с папуло-пустулезной формой вульгарных акне. Обследовано 63 пациента с вульгарными акне и 28 здоровых лиц в возрасте от 14 до 25 лет. Читать >
 Новые подходы в лечении среднетяжелых форм акне с применением препарата «Акнетин»
Новые подходы в лечении среднетяжелых форм акне с применением препарата «Акнетин»
Анализируя данные, полученные в результате лечения 28 пациентов «Акнетином», сопоставляя их с более ранним опытом применения изотретиноинов, можно сделать вывод о появлении на отечественном рынке европейского качественного и современного препарата изотретиноина с большей биодоступностью. А снижение разовой и курсовой кумулятивной доз на 20 % при сохранении клинической эффективности позволяет говорить о новом инновационном подходе к лечению средних и среднетяжелых форм угревой болезни. Читать >
 Опыт терапии больных с резистентными и тяжелыми формами акне и розацеа с использованием системного изотретиноина LIDOSE
Опыт терапии больных с резистентными и тяжелыми формами акне и розацеа с использованием системного изотретиноина LIDOSE
Цель работы — освещение опыта терапии больных с резистентными и тяжелыми формами акне и розацеа с использованием индивидуальных доз системного изотретиноина LIDOSE. Читать >


